肿瘤双抗治疗的战场再次传来重磅消息,一家中国创新药企与跨国巨头的牵手,不仅是单个药物的授权,更是全球肿瘤治疗格局加速演变的信号。
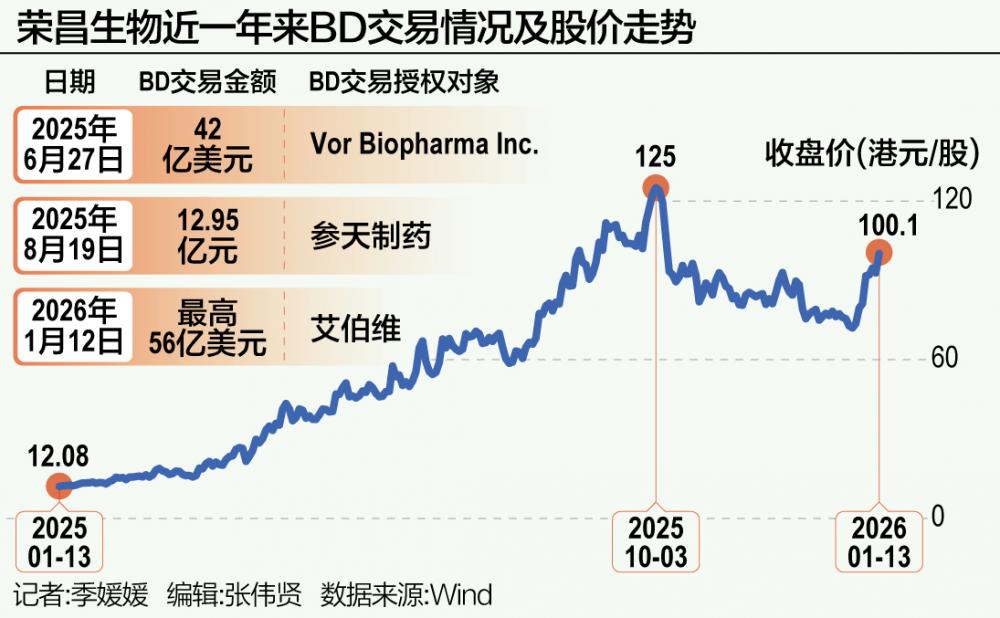
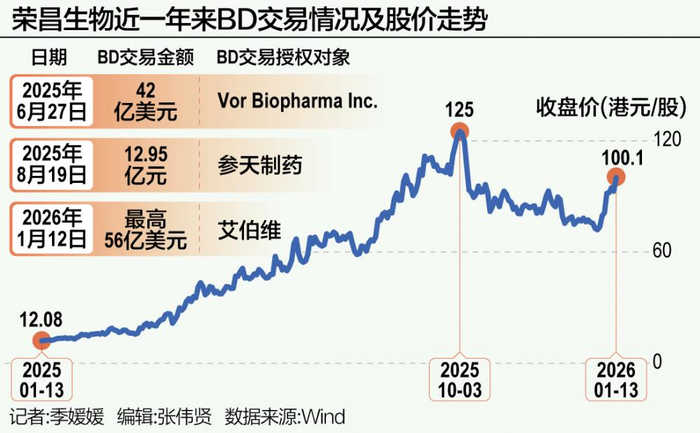
2026年1月12日,艾伯维(纽约证券交易所代码:ABBV)和荣昌生物宣布签署独家授权许可协议,共同开发、生产以及商业化RC148。RC148是一种靶向程序性细胞死亡蛋白1(PD-1)和血管内皮生长因子(VEGF)的新型在研双特异性抗体,目前荣昌生物正将其作为单药治疗及联合疗法,针对多种晚期实体肿瘤进行开发。
根据协议,艾伯维将获得RC148在大中华区以外地区的独家开发、生产和商业化权利。荣昌生物则将获得6.5亿美元的首付款,并有资格获得最高达49.5亿美元的开发、监管和商业化里程碑付款,以及大中华区以外地区净销售额的两位数分级特许权使用费。
有券商医药行业分析师对21世纪经济报道记者表示,从交易结构来看,这是一次典型的“中国创新+全球市场”模式。荣昌生物通过RC148的海外权益转让,不仅锁定了6.5亿美元首付款的现金流,还获得了最高可达49.5亿美元的里程碑收入,以及大中华区以外的销售分成。这笔交易对荣昌生物的意义在于,充裕的资金可加速RC148在中国及全球的临床试验推进,并支持其他管线的研发。同时,与全球顶尖肿瘤药企艾伯维合作,有助于提升荣昌生物在国际市场的品牌与议价能力。此外,海外市场开发的高投入与监管风险由艾伯维承担,使荣昌生物可以更专注于中国市场及后续管线布局。
“对艾伯维而言,RC148补充了其在免疫肿瘤学领域的产品组合,尤其是在PD-1/VEGF双抗这一新兴方向,有望与现有抗体偶联药物(ADC)、肿瘤免疫治疗(IO)药物形成协同,提升在实体瘤治疗中的竞争力。”该分析师说道。
双抗BD“热”
RC148是一种靶向PD-1和VEGF的在研双特异性抗体。
不同于传统单抗药物,靶向PD-1/VEGF的双特异性抗体代表了一类新型癌症疗法,旨在通过同时阻断PD-1和VEGF,帮助免疫系统更有效地对抗肿瘤,并可能克服肿瘤的耐药机制。此外,鉴于其在调节免疫抑制和构建有利于ADC药物活性的肿瘤微环境方面的潜力,PD-1/VEGF双特异性抗体也正被探索与ADC联合使用。在早期临床研究中,RC148与一种ADC联合应用已显示出初步良好的抗肿瘤活性。
值得一提的是,中国创新药企在该领域占据主导地位。2024年5月24日,康方生物的依沃西单抗(AK112/Ivonescimab)获准在国内上市。这款新药成为全球首款融合“肿瘤免疫+抗血管”双重机制的双特异性抗体药物,主要治疗经过EGFR酪氨酸激酶抑制剂(EGFRTKI)治疗后病情进展,携带有EGFR突变的局部晚期或转移性非鳞非小细胞肺癌(NSCLC)患者,为NSCLC患者提供了新的治疗选择。
三生制药的SSGJ707处于临床三期,同样具备较强竞争力。2025年5月20日,三生制药在ClinicalTrials.gov注册了PD-1/VEGF双抗SSGJ707的一项三期临床试验,用于一线治疗PD-L1阳性晚期非小细胞肺癌,计划入组420名局部晚期或转移性NSCLC患者,SSGJ707将作为单药头对头挑战默沙东PD-1单抗Keytruda(帕博利珠单抗)。同年10月16日,君实生物公告其自主研发的PD-1/VEGF双抗JS207获FDA批准开展Ⅱ/Ⅲ期临床试验,头对头对比百时美施贵宝的“O药”(纳武利尤单抗),用于Ⅱ/Ⅲ期可切除、AGA阴性非小细胞肺癌新辅助治疗。
分析师指出:“PD-1/VEGF双抗被视为继PD-1单抗后的重要迭代方向,能够同时解除免疫抑制和抑制血管生成,理论上可增强抗肿瘤效果并减少耐药。目前全球该领域主要玩家包括康方生物、君实生物、信达生物、百济神州、荣昌生物等。”
从BD合作来看,跨国药企对该赛道兴趣明显上升,主要因本土药企在双抗技术平台布局较为成熟,临床前及早期数据积极。此外,这类药物可与ADC、TIGIT、LAG3等免疫靶点形成联合疗法。目前中国企业在双抗研发速度和成本上具备优势,成为跨国药企重要合作伙伴。
艾伯维与荣昌生物的合作并非孤例。2025年以来,PD-1/VEGF双抗领域的BD交易已成常态。五家中国企业已成功实现该靶点双抗出海BD交易。2025年5月,三生制药与辉瑞达成合作,首付款达12.5亿美元,总交易金额60亿美元,一度刷新中国创新药BD首付款纪录;礼新医药与默沙东的交易总额达33亿美元;百时美施贵宝与BioNTech的PD-L1/VEGF-A双抗交易达到111亿美元,跻身全球单一创新药BD交易前三。
这些交易反映出跨国药企对中国创新药资产认可度提升。但BD交易并非一帆风顺。2026年初,宜明昂科宣布终止与Instil Bio合作,成为2026年首个BD“退货案”,合作金额止步于已收取的3500万美元。
针对终止合作原因,宜明昂科相关负责人表示:“对方海外临床推进速度实在太慢了。”关于后续海外临床布局,宜明昂科表示“我们先把海外已有数据转回来,继续谈合作伙伴。凭借目前现金流,纯靠自己开拓海外市场有一定挑战。眼下,我们会在国内大力推进临床进展,积累更多数据,这对后续BD拓展有帮助。”

中国创新药BD正当时
公开数据显示,2025年中国创新药对外授权交易总金额超过1300亿美元,授权交易数量超过150笔,远超2024年全年519亿美元和94笔。中国创新药交易额已占全球总额的49%,首次超过美国。全年创新药对外许可总金额为2024年的2.5倍,是美国同期的3.2倍。
这一变化背后有多重驱动因素。据行业机构预测,2025年至2030年间,随着多款重磅药物专利到期,全球制药业将迎来规模达2360亿美元的专利悬崖,约70款畅销药物面临竞品冲击。默沙东、百时美施贵宝、艾伯维、诺华等巨头或将遭受重创。同时,跨国药企内部研发效率持续下滑,2024年研发投资回报率为十余年最差,这促使其更加青睐外部创新。
BD热潮不仅是中国医药人自身感受。生物医药媒体Endpoints News发布的“2025年生物制药赢家和输家”榜单中,中国位列赢家。评语指出:“2025年中国生物制药行业异军突起,吸引大型跨国公司目光和资金,彰显中国不仅限于小分子药物和仿制药研发,中国在重要科学研究上的速度甚至超过美国同行。”
中国创新药BD交易火热,是多层因素共振结果。国家药监局数据显示,2025年中国批准上市创新药76个,包括47个化学药品、23个生物制品和6个中药。其中化学药品国产创新药占38个,进口创新药9个,国产占比达80.85%;生物制品国产创新药21个,进口2个,国产占比91.30%。
沙利文大中华区合伙人兼董事总经理毛化对21世纪经济报道记者表示,随着中国创新药全球地位提升,企业在对外授权(License-out)和合作开发中的议价能力,正从“单点项目驱动”向“体系能力驱动”转变。
毛化指出,要系统性提升议价能力,关键不只依赖单一管线,更在于企业能否构建整套被国际合作方认可的价值创造逻辑。首先,管线本身核心竞争力至关重要。企业需围绕未满足的临床需求做前瞻性布局,避免同质化严重的热门赛道,借助差异化靶点、创新机制或更优给药方式形成比较优势。同时,高质量数据也是国际合作方关注的重点,不仅看结果,更看研发逻辑与执行力。
其次,议价能力提升紧密依赖交易结构设计成熟度。相较单一首付款定价,多层次结构如首付款、里程碑付款与销售分成的灵活使用,有助在不同风险阶段实现价值动态释放。对具确定性的优质资产,应争取长期权益与分成比例;早期项目可通过结构设计获取更高隐含估值。这种结构化谈判能力是国际BD体系的重要“软实力”。
此外,企业整体研发与组织能力亦影响交易谈判结果。具备多管线布局、连续交付及清晰研发节奏的公司,更易被视为长期合作伙伴,而非一次性资产出售方。这种“平台型”认知助力谈判中获得更大灵活空间,如保留区域权益、共同开发权或后续选择权等。
当前全球创新药投资聚焦“高临床价值+未满足需求”领域。中国企业在部分赛道——如ADC、双抗、细胞基因治疗、自身免疫疾病等——已展现差异化优势。2026年初,中国创新药领域显示积极态势,越来越多跨国公司愿为中国创新药支付“真金白银”。
目前,中国创新药发展方向愈加清晰,中国医药创新正经历从跟随到领先的关键转折。
(作者:季媛媛 编辑:张伟贤)
https://finance.sina.com.cn/roll/2026-01-14/doc-inhhfmmf4303983.shtml